|
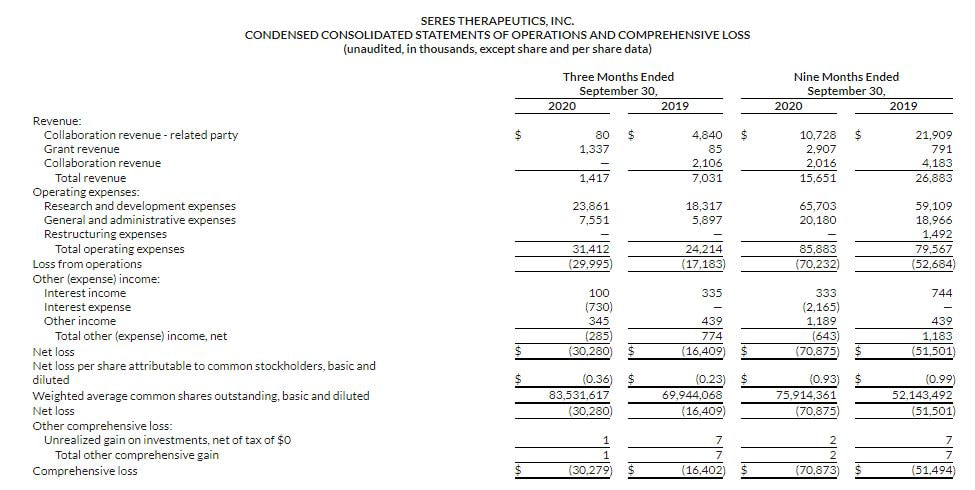
Seres Therapeutics社は新型コロナウイルスで改めて懸念が高まった糞便移植(FMT)による感染リスクに対し、経口投与型の同社のSER-109との違いと、GMP(Good Manufacturing Practice)に基づき、品質管理等が取られていることを強調し、差別化を図りました。Phase 3は治療後12週間で、SER-109群の再発率が16.7%であったのに対し、プラセボ群では47.8%であり、絶対リスクが31.1%減少したことが示され、少なくともFMTと同等の治療効果が出たとされます。SER-109は、2021年に米国で承認される可能性があります。 2020年第三四半期財務状況によると約3000万米ドルの損失が出ています。前年度同期比が約1600万米ドルの損失で、損失規模は拡大しています。一方でネスレ社を通じ、公募増資等をした結果、現金資産を増やし、事業経費も増大させました。 (Seres Therapeutics, 2020) いすれにしても早期の製品実用化が期待されます。 References Seres Therapeutics. (2020). Reported ECOSPOR III Phase 3 study of SER-109 met primary endpoint, demonstrated statistically significant absolute reduction of 30.2% in rate of C. difficile infection recurrence compared to placebo. Retrieved from https://ir.serestherapeutics.com/news-releases/news-release-details/seres-therapeutics-reports-third-quarter-2020-financial-results
Comments are closed.
|
Author沖為工作室合同会社 Categories
All
Archives
July 2024
|
 RSS Feed
RSS Feed